肝脏海绵状血管瘤是一种较为常见的肝脏良性肿瘤。除皮肤和黏膜外,肝脏是海绵状血管瘤的最好发部位,可单发或多发,有蒂或无蒂,多见于肝脏表面,其体积从针尖至核桃或儿头大小,严重者可占据整个肝脏,向腹部明显膨出。肿瘤质地柔软,切面呈蜂窝状,内充满血液,有弹性,可压缩。肿瘤初发生时不产生任何症状,逐渐长大后因压迫周围脏器引起一系列症状,也可导致心力衰竭等并发症。随着瘤体逐渐增大,若不予治疗,可发生破裂引起大出血的危险。
肝海绵状血管瘤的确切发病原因不明,有以下几种学说。 1.发育异常学说 目前普遍认为在胚胎发育过程中,由于血管发育异常,引起肿瘤样增生而形成血管瘤。有些在出生时即存在,或在出生后不久即能看到,亦说明为先天发育异常。 2.其他学说 毛细血管组织感染后变形,导致毛细血管扩张;肝组织局部坏死后血管扩张形成空泡状,其周围血管充血、扩张;肝内区域性血循环停滞,致使血管形成海绵状扩张;肝内出血后,血肿机化、血管再通后形成血管扩张。
肝海绵状血管瘤以血管扩张形式呈膨胀性生长,并非是以新生血管增生为主的恶性增大。内分泌因素的改变对血管瘤的生长有一定影响。妊娠期或口服雌激素会使血管瘤迅速增大而出现症状。 肝海绵状血管瘤大小不一,小至针头样,大的可重达10余kg。肉眼观为紫红色或蓝紫色,可呈不规则分叶状,界限清晰,有不规则的纤维性包膜,质地柔软,表面光滑,有弹性感及压缩充盈现象,亦可因纤维化而坚硬。多数血管瘤常可见到退行性病理变化,如包膜纤维性硬化、陈旧性血栓机化、玻璃样变伴有胶原增加甚至钙化。海绵状血管瘤一般位于肝包膜下,也可深居于肝实质内,此时肝表面可呈凹陷或隆起,与周围肝实质分界明显。肝海绵状血管瘤可合并肝囊肿和肝腺瘤,很少与肝硬化同时存在。目前为止,文献资料未见肝海绵状血管瘤恶变的报道。 肝血管瘤切面为网眼状,依据其纤维组织多少,可分为以下4型。 海绵状血管瘤:最常见。一般所谓的肝血管瘤就是指海绵状血管瘤。切面呈蜂窝状,内充满血液。光镜下可见大小不等的囊状血窦,血窦壁内衬覆一层内皮细胞,血窦内常充满红细胞,有时有血栓形成,血窦之间为纤维组织所分隔,偶见有被压缩的细胞索,大的纤维分隔内有血管和小胆管,纤维分隔和管腔可发生钙化或静脉石形成。瘤体周围常有一层纤维包膜与正常肝组织分界。 硬化性血管瘤:血管腔塌陷或闭合,间隔纤维组织极丰富,血管瘤呈退行性改变。 血管内皮细胞瘤:血管内皮细胞增生活跃,易恶变,常与血管内皮细胞肉瘤相混淆。 毛细血管瘤:少见。其特点为血管腔狭窄,间隔纤维组织丰富。[收起]
肝海绵状血管瘤以血管扩张形式呈膨胀性生长,并非是以新生血管增生为主的恶性增大。内分泌因素的改变对血管瘤的生长有一定影响。妊娠期或口服雌激素会使血管瘤迅速增大而出现症状。 肝海绵状血管瘤大小不一,小至针头样,大的可重达10余kg。肉眼观为紫红色或蓝紫色,可呈不规则分叶状,界限清晰,有不规则的纤维性包膜,质地柔软,表面光滑,有弹性感及压缩充盈现象,亦可因纤维化而坚硬。多数血管瘤常可见到退行性病理变化,如包膜纤维性硬化、陈旧性血栓机化、玻璃样变伴有胶原增加甚至钙化。海绵状血管瘤一般位于肝包膜下,也可深居于肝实质内,此时肝表面可呈凹陷或隆起,与周围肝实质分界明显。肝海绵状血管瘤可合并肝囊肿...[详细]
本肿瘤生长缓慢,病程较长,病史可追溯到多年以前。根据临床表现分为: 1.无症状型 此型占绝大多数(80%以上),终身无任何感觉,多在健康体检常规行B超检查或行腹部手术时意外地被发现。 2.有症状型 通常肿瘤直径超过4cm以上时,可出现症状。常见的症状有: (1)腹部包块:半数以上患者有此体征。包块有囊性感;无压痛,表面光滑或不光滑,软硬不一,随呼吸上下移动,有的在包块部听诊可听到传导的血管杂音。 (2)胃肠道症状:可出现右上腹隐痛和不适,以及食欲不振、恶心、呕吐、嗳气、食后胀饱和消化不良等。 (3)压迫症状:肿瘤压迫食管下端,可出现吞咽困难;压迫肝外胆道,可出现阻塞性黄疸和胆囊积液;压迫门静脉系统,可出现脾大和腹水;压迫肺脏,可出现呼吸困难和肺不张;压迫胃和十二指肠,可出现消化道症状;等等。[收起]
本肿瘤生长缓慢,病程较长,病史可追溯到多年以前。根据临床表现分为: 1.无症状型 此型占绝大多数(80%以上),终身无任何感觉,多在健康体检常规行B超检查或行腹部手术时意外地被发现。 2.有症状型 通常肿瘤直径超过4cm以上时,可出现症状。常见的症状有: (1)腹部包块:半数以上患者有此体征。包块有囊性感;无压痛,表面光滑或不光滑,软硬不一,随呼吸上下移动,有的在包块部听诊可听到传导的血管杂音。 (2)胃肠道症状:可出现右上腹隐痛和不适,以及食欲不振、恶心、呕吐、嗳气、食后胀饱和消化不良等。 (3)压迫症状:肿瘤压迫食管下端,可出...[详细]
肿瘤破裂出血,可出现上腹部剧痛以及出血和休克症状;游离在肝外生长的带蒂肿瘤扭转时,可发生肿瘤坏死,出现腹部剧痛、发热和虚脱。也有个别病例因血管瘤巨大,有动静脉瘘形成,致回心血量增多和加重心脏负担,导致心力衰竭而死亡。
对本病的诊断帮助不大,一般肝功能均正常,酶活性不高。少数患者有红、白细胞及血小板减少,切除血管瘤后可恢复正常。血象变化在巨大肝海绵状血管瘤病例中较为常见。长海医院肝外科80年代报道的一组40例直径在15cm以上的巨大肝海绵状血管瘤患者中,有半数血红蛋白在1.55mmol/L(10g)以下,最低仅0.96mmol/L(6.2g);有3/4病例的白细胞计数在5.0×109/L以下,最低仅2.2×109/L;有1/3患者血小板计数在100×109/L以下,最低仅40×109/L,上述变化经手术切除血管瘤后均恢复正常。其贫血和血小板减少可能与瘤内血栓形成,从而破坏红细胞和消耗大量血小板有关。
肝脏海绵状血管瘤的诊断主要依赖于影像学检查: 1.超声检查 近70%的血管瘤呈强回声,且内部回声均匀,余者可呈低回声、等回声或混合回声,如有钙化可见强回声后伴声影。彩色多普勒超声检查显示血管瘤内血流信号少见,部分血管瘤可出现中央部血池样充填。 2.CT扫描 海绵状血管瘤CT平扫表现为低密度,且密度均匀,大的血管瘤病灶中央可见更低密度区,呈星形、裂隙状或不规则形。瘤内偶见钙化,呈圆形或不定形强回声,病灶边缘通常清晰光滑。典型者增强扫描表现为早期病灶边缘呈高密度强化,随后增强区进行性向中心扩展,延迟扫描病灶呈等密度充填,显示“快进慢出”的表现。直径小于3cm的血管瘤增强扫描表现较为复杂,可有以下表现:病灶早期呈高密度强化,也有的病灶强化不显著,低于正常肝组织,延迟扫描所有病灶均呈等密度充填。个别病例始终无强化,延迟扫描也无充填,此类血管瘤管壁很厚,管腔狭小,造影剂难以进入。 3.核素肝血池扫描 对肝脏海绵状血管瘤的诊断价值较高,用99mTc标记红细胞,有血流的地方即可显像,血流丰富或淤滞者核素浓聚。肝脏海绵状血管瘤表现为5min开始在血管瘤的部位有放射性核素浓聚,逐渐增浓,1h后仍不消散,这种缓慢的放射性过度填充现象是诊断肝脏海绵状血管瘤的特征性依据。 4.MRI检查 表现为长T1长T2信号,T2像呈相对高信号,呈“灯泡征”。 5.肝动脉造影 系一种有创性检查方法,对血管瘤的敏感性及特异性均高,早期注药后2~3s病灶周边即有染色,造影剂清除缓慢,可充盈持续18s以上,造影剂的这种快进慢出的现象是血管瘤的典型特征,称之为“早出晚归征”。 有人提议,对肝脏海绵状血管瘤的诊断,凡超声检查提示肝内直径约3cm大小的局灶占位病变,应以CT或MRI来验证,结果不相符者应作肝血池扫描或肝动脉造影检查,鉴别困难者可行超声引导下穿刺活检。过去对可疑肝脏海绵状血管瘤穿刺活检强调用细针,但细针穿刺活检结果表明,约50%肝脏海绵状血管瘤镜下难以观察到典型的血管瘤结构,仅以涂片未找到肿瘤细胞等依据诊断肝脏海绵状血管瘤。近5年来,董宝玮等对有安全入路(穿刺针道经过至少1cm正常肝实质再进入肿块)的肝脏海绵状血管瘤采用18G粗针穿刺,可得到较大的组织标本,确诊率可达90%。由于穿刺过程采用切割式的自动弹射活检装置,切割速度快,因此与用20G细穿刺针相比,出血等并发症发生率并无明显提高,在掌握好适应证的情况下可以推荐用18G穿刺针活检。[收起]
肝脏海绵状血管瘤的诊断主要依赖于影像学检查: 1.超声检查 近70%的血管瘤呈强回声,且内部回声均匀,余者可呈低回声、等回声或混合回声,如有钙化可见强回声后伴声影。彩色多普勒超声检查显示血管瘤内血流信号少见,部分血管瘤可出现中央部血池样充填。 2.CT扫描 海绵状血管瘤CT平扫表现为低密度,且密度均匀,大的血管瘤病灶中央可见更低密度区,呈星形、裂隙状或不规则形。瘤内偶见钙化,呈圆形或不定形强回声,病灶边缘通常清晰光滑。典型者增强扫描表现为早期病灶边缘呈高密度强化,随后增强区进行性向中心扩展,延迟扫描病灶呈等密度充填,显示“快进慢出”的表现。直径小于3cm的血管瘤增强...[详细]
肝海绵状血管瘤的诊断一般不难,绝大多数可通过无症状、无肝炎史,AFP(-),结合2个或2个以上的典型影像学表现而确诊。
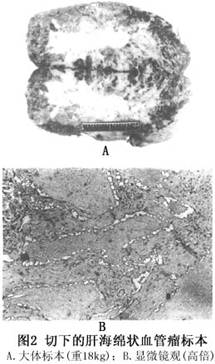
肝海绵状血管瘤的治疗取决于肿瘤的大小、部位和生长速度等。对于血管瘤直径小于5cm且无任何临床症状又生长于肝实质内者,不需特殊处理,可门诊随访,B超观察瘤体的变化,如有明显增大再行手术治疗;而直径大于5cm或有临床症状者,因瘤体增大出现对周围脏器的压迫症状和对心血管系统的不利影响,或可能出现瘤体破裂危及生命者,则应进行有效的治疗。目前,对肝血管瘤的治疗方法,主要有肝叶切除术、血管瘤捆扎术、肝动脉结扎术,肝动脉栓塞术、冷冻治疗、微波固化术、瘤体内硬化剂注射术和放射治疗等。 1.肝叶切除术 肝叶切除术仍然是目前治疗血管瘤最好的方法。但因血管瘤血供丰富,术中极易出血,特别是巨大的肝海绵状血管瘤,由于肿瘤挤压邻近脏器,局部解剖关系移位,手术难度更大,故应严格掌握手术适应证。对单发血管瘤,尤其是位于肝周边或病变局限于肝的一侧者,可作肝局部切除、肝叶切除或半肝切除术;如病变范围已超过半肝,余肝明显代偿增大,且无肝硬化,肝功能正常者,可作肝三叶切除术。国内一组1120例患者中,行手术切除有683例,其中1例46岁男性患者(图1)为肝脏特大海绵状血管瘤,肿瘤体积63cm×48.5cm×40cm,占据肝右三叶,行肝右三叶切除术,肿瘤重18kg(图2),术后恢复顺利,至今已24年,情况良好,可参加正常劳动。对病变已累及第一、二肝门或病变广泛,压迫邻近脏器引起症状者,也应尽量将主要病变或压迫邻近脏器的肝叶或肝段切除,余下的少量残瘤可进行血管瘤捆扎术或放射治疗。另有1例53岁男性患者,病变位于左外叶及右三叶上段靠近第二肝门,整个左外叶被肿瘤占据,瘤大20cm×10cm×10cm,作了左外叶切除,术后残瘤进行60Co照射50Gy,至今已30年情况良好,残瘤未见增大。肝叶切除治疗肝血管瘤的主要问题是如何控制术中出血。特别是巨大肝血管瘤,由于血供丰富,瘤体大,解剖变位,加上瘤体本身容易出血,从而增加了手术难度,且可能引起术中难以控制的大出血,所以,肝海绵状血管瘤行肝叶切除术时如何控制出血,是手术成功的关键。总结683例手术经验,肝血管瘤行肝切除中应注意以下几点: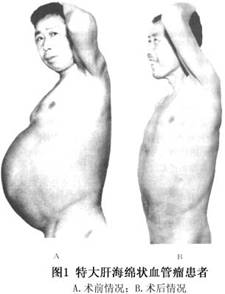
 (1)充分显露肿瘤,一般作肋缘下斜切口,如果肿瘤位于右半肝,切口可自剑突沿右肋缘下至右第12肋;如果肿瘤位于左半肝,显露困难,则可以采用双肋缘下“人”字形切口,这样可充分显露肿瘤便于操作;对于需行右三叶切除的巨大肝血管瘤,必要时可作胸腹联合切口。 (2)充分游离肝脏,在分离肿瘤和切肝前,可先结扎患侧肝动脉,使肿瘤缩小、变软,有利于手术操作。通常采用先在肝十二指肠韧带处放置一根橡皮管,以阻断入肝血流,更便于分离和切除肿瘤,且可防止手术过程中大出血。切肝前应仔细分离、切断和结扎肿瘤周围诸韧带及粘连组织,使肿瘤和患侧肝脏充分游离,游离的程度以达到术者可以用手握住肝切线并控制肝创面出血为原则。对于右肝巨大血管瘤已达肝后下腔静脉前壁者,充分游离右侧肝脏后,可以将肝脏向左侧翻转,仔细分离,暴露下腔静脉前壁的肝短静脉,逐根结扎,以免切肝时撕破下腔静脉壁或拉断肝短静脉。 (3)切肝应在常温下阻断肝门后进行,每次阻断时间为15~20min,如1次阻断未能切下,放松3~5min后,再行第2次阻断,直至把肿瘤切下为止;如果有可能,可以选择性地阻断患侧肝脏的肝门,这样可以延长阻断时间。 (4)肝切线的选择,肝切线应选在偏向或靠近正常肝组织处,用血管钳边钳夹、边切断结扎所有断面血管和胆管。直至肿瘤完全切除。多发性血管瘤或血管瘤病变广泛,需作局部或主瘤切除者,应注意切线尽量靠近正常肝组织,不然易引起大出血;切忌在瘤体上切割或缝扎,以免造成渗血不止;待主瘤切除后,小的血管瘤可用捆扎法处理。 (5)肿瘤切除后,应对肝创面进行彻底止血,活动性出血可以行“8”字缝合,无明显出血后,可用一片游离大网膜覆盖肝创面并缝合固定,也可用对拢缝合肝创面。后腹膜粗糙面予以缝合止血,膈下置双套管持续负压吸引。 (6)对巨大肝海绵状血管瘤切除时,术前还应从颈外静脉或颈内静脉或大隐静脉放置中心静脉导管至右心房附近,供输液或输血或术中测量中心静脉压用。因瘤体可压迫下腔静脉,造成静脉回流不畅,故全部输液输血应在上肢进行,并常规显露一侧桡动脉,以便在大出血时作紧急动脉输血用,以利提高手术安全性。 2.血管瘤捆扎术 对血管瘤直径在15cm以下、多发性小血管瘤或主瘤切除后其他肝叶散在的小血管瘤,均可采用血管瘤捆扎术。在采用血管瘤捆扎术治疗时,亦应先预置肝门阻断管。切断肝周韧带,使血管瘤充分游离后,阻断第一肝门进而使血管瘤缩小,然后用手指轻压瘤体,用大号弯圆针,7号或10号丝线从靠近血管瘤的正常肝组织进针,并经过肿瘤基底部,再从肿瘤另一侧正常肝组织出针,暂不结扎,依血管瘤大小,用同样方法间断或“8”字形缝合(针距1~1.5cm),缝合整个瘤体,然后逐一收紧打结。捆扎时应注意进针不可经瘤体,以免放松肝门阻断后,从针眼处发生大出血。这种方法能很好地达到控制血管瘤生长的目的。 3.肝动脉结扎和肝动脉栓塞术 对多发性血管瘤或病变范围极大,已侵犯大部分肝组织或紧邻大血管,无法切除者,可作肝动脉结扎或栓塞术,根据病变范围可作肝右、肝左或肝固有动脉结扎术。结扎后大部分肿瘤可变软缩小,该法对囊状血管瘤的疗效甚为满意。在肿瘤缩小的基础上,术后加用放射治疗可促使肿瘤机化变硬,对改善症状、控制肿瘤生长有一定的作用。在一组收治的1120例中,有33例行肝动脉结扎或栓塞术,其中1例34岁女性患者,其肝上界达右锁骨中线第4肋间,下界达右肋缘下14cm,剑下12cm。术中见血管瘤侵犯全肝,无法手术切除,行肝固有动脉结扎术。术后1个月肿瘤明显缩小,肝下缘在右肋缘下9cm,剑下9cm。后经60Co照射60Gy,肿瘤继续缩小。随访21年,肝上界在右锁骨中线第5肋间,下界右肋缘下2cm,剑下3cm,质地变硬,患者体重增加,肝功能正常,已恢复工作。 近年来,随着介入放射学技术的发展,对已确诊为肝海绵状血管瘤且手术切除可能性较小的患者,可经股动脉行肝动脉栓塞术,亦能达到控制血管瘤发展的目的。常用的栓塞剂为碘油、微球(清蛋白微球、明胶微球及乙基纤维素微球等)、吸收性明胶海绵等,亦可用记忆合金钢圈行永久性栓塞。根据病变范围可行肝左或肝右动脉栓塞,通常无不良反应,术后大部分患者可见肿瘤缩小。 4.冷冻治疗 对既不能手术切除,又无法作动脉结扎的肝海绵状血管瘤,且经股动脉行肝动脉栓塞失败者,可在肝门阻断、肿瘤变软缩小后,再用冷冻疗法。一般用液氮,温度最低可达-196℃。冷冻方法大致有3种:①接触冷冻:将冷冻头置于组织表面加压冷冻,可产生半球形冰冻块,冷冻深度约为冷冻面积的半径;②插入冷冻:用针形冷冻头插入血管瘤内,以达到较深部位的治疗;③液氮直接喷冻:适用于表面积较大的弥漫性浅表病变。冷冻时间取决于冷冻方法、病灶大小和深浅度。通常冷冻15min可达80%~90%最大冷冻效应,故一般单次冷冻15~30min。在快速冷冻、缓慢自然溶解过程中,能使冷冻区产生凝固性坏死。术中可用2支热电偶针分别监测冷冻区及边缘肝组织的温度。在肝门阻断下冷冻1次效应相当于不阻断肝门冷冻的2~3次。术后ALT可有一过性升高,多在1~2周内恢复正常。胆囊及一、二级胆管冷冻后有破溃形成胆漏的危险,故对位于肝门部的血管瘤不宜采用此法。 5.微波固化术 对巨大血管瘤无法暴露肝门或第一、二肝门受侵犯,范围太大无法行肿瘤切除者,可采用微波固化。对因瘤体巨大妨碍肝门显露者,可先行微波固化至瘤体明显缩小后再行血管瘤切除。对于无法切除者,单纯做微波高温固化治疗亦可获得较满意的疗效。 在1120例患者中,采用微波固化治疗巨大肝血管瘤23例,最大瘤体直径26cm。全部病例肿瘤经固化治疗后,肿瘤直径可缩小70%~90%,解除了压迫症状,显著减轻了患者的痛苦。其中2例分别于术后3个月、20个月对缩小后的血管瘤作手术切除,切除标本中可见血管瘤已完全纤维化。 6.瘤体内硬化剂注射术 最常采用的是[收起]
肝海绵状血管瘤的治疗取决于肿瘤的大小、部位和生长速度等。对于血管瘤直径小于5cm且无任何临床症状又生长于肝实质内者,不需特殊处理,可门诊随访,B超观察瘤体的变化,如有明显增大再行手术治疗;而直径大于5cm或有临床症状者,因瘤体增大出现对周围脏器的压迫症状和对心血管系统的不利影响,或可能出现瘤体破裂危及生命者,则应进行有效的治疗。目前,对肝血管瘤的治疗方法,主要有肝叶切除术、血管瘤捆扎术、肝动脉结扎术,肝动脉栓塞术、冷冻治疗、微波固化术、瘤体内硬化剂注射术和放射治疗等。 1.肝叶切除术 肝叶切除术仍然是目前治疗血管瘤最好的方法。但因血管瘤血供丰富,术中极易出血,特别是巨大的肝海绵状...[详细]
(1)充分显露肿瘤,一般作肋缘下斜切口,如果肿瘤位于右半肝,切口可自剑突沿右肋缘下至右第12肋;如果肿瘤位于左半肝,显露困难,则可以采用双肋缘下“人”字形切口,这样可充分显露肿瘤便于操作;对于需行右三叶切除的巨大肝血管瘤,必要时可作胸腹联合切口。 (2)充分游离肝脏,在分离肿瘤和切肝前,可先结扎患侧肝动脉,使肿瘤缩小、变软,有利于手术操作。通常采用先在肝十二指肠韧带处放置一根橡皮管,以阻断入肝血流,更便于分离和切除肿瘤,且可防止手术过程中大出血。切肝前应仔细分离、切断和结扎肿瘤周围诸韧带及粘连组织,使肿瘤和患侧肝脏充分游离,游离的程度以达到术者可以用手握住肝切线并控制肝创面出血为原则。对于右肝巨大血管瘤已达肝后下腔静脉前壁者,充分游离右侧肝脏后,可以将肝脏向左侧翻转,仔细分离,暴露下腔静脉前壁的肝短静脉,逐根结扎,以免切肝时撕破下腔静脉壁或拉断肝短静脉。 (3)切肝应在常温下阻断肝门后进行,每次阻断时间为15~20min,如1次阻断未能切下,放松3~5min后,再行第2次阻断,直至把肿瘤切下为止;如果有可能,可以选择性地阻断患侧肝脏的肝门,这样可以延长阻断时间。 (4)肝切线的选择,肝切线应选在偏向或靠近正常肝组织处,用血管钳边钳夹、边切断结扎所有断面血管和胆管。直至肿瘤完全切除。多发性血管瘤或血管瘤病变广泛,需作局部或主瘤切除者,应注意切线尽量靠近正常肝组织,不然易引起大出血;切忌在瘤体上切割或缝扎,以免造成渗血不止;待主瘤切除后,小的血管瘤可用捆扎法处理。 (5)肿瘤切除后,应对肝创面进行彻底止血,活动性出血可以行“8”字缝合,无明显出血后,可用一片游离大网膜覆盖肝创面并缝合固定,也可用对拢缝合肝创面。后腹膜粗糙面予以缝合止血,膈下置双套管持续负压吸引。 (6)对巨大肝海绵状血管瘤切除时,术前还应从颈外静脉或颈内静脉或大隐静脉放置中心静脉导管至右心房附近,供输液或输血或术中测量中心静脉压用。因瘤体可压迫下腔静脉,造成静脉回流不畅,故全部输液输血应在上肢进行,并常规显露一侧桡动脉,以便在大出血时作紧急动脉输血用,以利提高手术安全性。 2.血管瘤捆扎术 对血管瘤直径在15cm以下、多发性小血管瘤或主瘤切除后其他肝叶散在的小血管瘤,均可采用血管瘤捆扎术。在采用血管瘤捆扎术治疗时,亦应先预置肝门阻断管。切断肝周韧带,使血管瘤充分游离后,阻断第一肝门进而使血管瘤缩小,然后用手指轻压瘤体,用大号弯圆针,7号或10号丝线从靠近血管瘤的正常肝组织进针,并经过肿瘤基底部,再从肿瘤另一侧正常肝组织出针,暂不结扎,依血管瘤大小,用同样方法间断或“8”字形缝合(针距1~1.5cm),缝合整个瘤体,然后逐一收紧打结。捆扎时应注意进针不可经瘤体,以免放松肝门阻断后,从针眼处发生大出血。这种方法能很好地达到控制血管瘤生长的目的。 3.肝动脉结扎和肝动脉栓塞术 对多发性血管瘤或病变范围极大,已侵犯大部分肝组织或紧邻大血管,无法切除者,可作肝动脉结扎或栓塞术,根据病变范围可作肝右、肝左或肝固有动脉结扎术。结扎后大部分肿瘤可变软缩小,该法对囊状血管瘤的疗效甚为满意。在肿瘤缩小的基础上,术后加用放射治疗可促使肿瘤机化变硬,对改善症状、控制肿瘤生长有一定的作用。在一组收治的1120例中,有33例行肝动脉结扎或栓塞术,其中1例34岁女性患者,其肝上界达右锁骨中线第4肋间,下界达右肋缘下14cm,剑下12cm。术中见血管瘤侵犯全肝,无法手术切除,行肝固有动脉结扎术。术后1个月肿瘤明显缩小,肝下缘在右肋缘下9cm,剑下9cm。后经60Co照射60Gy,肿瘤继续缩小。随访21年,肝上界在右锁骨中线第5肋间,下界右肋缘下2cm,剑下3cm,质地变硬,患者体重增加,肝功能正常,已恢复工作。 近年来,随着介入放射学技术的发展,对已确诊为肝海绵状血管瘤且手术切除可能性较小的患者,可经股动脉行肝动脉栓塞术,亦能达到控制血管瘤发展的目的。常用的栓塞剂为碘油、微球(清蛋白微球、明胶微球及乙基纤维素微球等)、吸收性明胶海绵等,亦可用记忆合金钢圈行永久性栓塞。根据病变范围可行肝左或肝右动脉栓塞,通常无不良反应,术后大部分患者可见肿瘤缩小。 4.冷冻治疗 对既不能手术切除,又无法作动脉结扎的肝海绵状血管瘤,且经股动脉行肝动脉栓塞失败者,可在肝门阻断、肿瘤变软缩小后,再用冷冻疗法。一般用液氮,温度最低可达-196℃。冷冻方法大致有3种:①接触冷冻:将冷冻头置于组织表面加压冷冻,可产生半球形冰冻块,冷冻深度约为冷冻面积的半径;②插入冷冻:用针形冷冻头插入血管瘤内,以达到较深部位的治疗;③液氮直接喷冻:适用于表面积较大的弥漫性浅表病变。冷冻时间取决于冷冻方法、病灶大小和深浅度。通常冷冻15min可达80%~90%最大冷冻效应,故一般单次冷冻15~30min。在快速冷冻、缓慢自然溶解过程中,能使冷冻区产生凝固性坏死。术中可用2支热电偶针分别监测冷冻区及边缘肝组织的温度。在肝门阻断下冷冻1次效应相当于不阻断肝门冷冻的2~3次。术后ALT可有一过性升高,多在1~2周内恢复正常。胆囊及一、二级胆管冷冻后有破溃形成胆漏的危险,故对位于肝门部的血管瘤不宜采用此法。 5.微波固化术 对巨大血管瘤无法暴露肝门或第一、二肝门受侵犯,范围太大无法行肿瘤切除者,可采用微波固化。对因瘤体巨大妨碍肝门显露者,可先行微波固化至瘤体明显缩小后再行血管瘤切除。对于无法切除者,单纯做微波高温固化治疗亦可获得较满意的疗效。 在1120例患者中,采用微波固化治疗巨大肝血管瘤23例,最大瘤体直径26cm。全部病例肿瘤经固化治疗后,肿瘤直径可缩小70%~90%,解除了压迫症状,显著减轻了患者的痛苦。其中2例分别于术后3个月、20个月对缩小后的血管瘤作手术切除,切除标本中可见血管瘤已完全纤维化。 6.瘤体内硬化剂注射术 最常采用的是[收起]
肝海绵状血管瘤的治疗取决于肿瘤的大小、部位和生长速度等。对于血管瘤直径小于5cm且无任何临床症状又生长于肝实质内者,不需特殊处理,可门诊随访,B超观察瘤体的变化,如有明显增大再行手术治疗;而直径大于5cm或有临床症状者,因瘤体增大出现对周围脏器的压迫症状和对心血管系统的不利影响,或可能出现瘤体破裂危及生命者,则应进行有效的治疗。目前,对肝血管瘤的治疗方法,主要有肝叶切除术、血管瘤捆扎术、肝动脉结扎术,肝动脉栓塞术、冷冻治疗、微波固化术、瘤体内硬化剂注射术和放射治疗等。 1.肝叶切除术 肝叶切除术仍然是目前治疗血管瘤最好的方法。但因血管瘤血供丰富,术中极易出血,特别是巨大的肝海绵状...[详细]
本病发展较慢,预后良好。但由于某种原因,如妊娠或青年运动员,可因妊娠或剧烈运动促使瘤体迅速增大,或因外伤、分娩、体格检查时过重的手法按压瘤体,均可招致肿瘤破裂,危及生命。Errico报道14例肝海绵状血管瘤破裂者,仅救活2例。据报道,儿童血管瘤自发性破裂者较多,且血小板减少症及低纤维蛋白原血症等并发症的发生率也明显高于成人,因此,对儿童肝海绵状血管瘤确诊后应尽早治疗。



 (1)充分显露肿瘤,一般作肋缘下斜切口,如果肿瘤位于右半肝,切口可自剑突沿右肋缘下至右第12肋;如果肿瘤位于左半肝,显露困难,则可以采用双肋缘下“人”字形切口,这样可充分显露肿瘤便于操作;对于需行右三叶切除的巨大肝血管瘤,必要时可作胸腹联合切口。 (2)充分游离肝脏,在分离肿瘤和切肝前,可先结扎患侧肝动脉,使肿瘤缩小、变软,有利于手术操作。通常采用先在肝十二指肠韧带处放置一根橡皮管,以阻断入肝血流,更便于分离和切除肿瘤,且可防止手术过程中大出血。切肝前应仔细分离、切断和结扎肿瘤周围诸韧带及粘连组织,使肿瘤和患侧肝脏充分游离,游离的程度以达到术者可以用手握住肝切线并控制肝创面出血为原则。对于右肝巨大血管瘤已达肝后下腔静脉前壁者,充分游离右侧肝脏后,可以将肝脏向左侧翻转,仔细分离,暴露下腔静脉前壁的肝短静脉,逐根结扎,以免切肝时撕破下腔静脉壁或拉断肝短静脉。 (3)切肝应在常温下阻断肝门后进行,每次阻断时间为15~20min,如1次阻断未能切下,放松3~5min后,再行第2次阻断,直至把肿瘤切下为止;如果有可能,可以选择性地阻断患侧肝脏的肝门,这样可以延长阻断时间。 (4)肝切线的选择,肝切线应选在偏向或靠近正常肝组织处,用血管钳边钳夹、边切断结扎所有断面血管和胆管。直至肿瘤完全切除。多发性血管瘤或血管瘤病变广泛,需作局部或主瘤切除者,应注意切线尽量靠近正常肝组织,不然易引起大出血;切忌在瘤体上切割或缝扎,以免造成渗血不止;待主瘤切除后,小的血管瘤可用捆扎法处理。 (5)肿瘤切除后,应对肝创面进行彻底止血,活动性出血可以行“8”字缝合,无明显出血后,可用一片游离大网膜覆盖肝创面并缝合固定,也可用对拢缝合肝创面。后腹膜粗糙面予以缝合止血,膈下置双套管持续负压吸引。 (6)对巨大肝海绵状血管瘤切除时,术前还应从颈外静脉或颈内静脉或大隐静脉放置中心静脉导管至右心房附近,供输液或输血或术中测量中心静脉压用。因瘤体可压迫下腔静脉,造成静脉回流不畅,故全部输液输血应在上肢进行,并常规显露一侧桡动脉,以便在大出血时作紧急动脉输血用,以利提高手术安全性。 2.血管瘤捆扎术 对血管瘤直径在15cm以下、多发性小血管瘤或主瘤切除后其他肝叶散在的小血管瘤,均可采用血管瘤捆扎术。在采用血管瘤捆扎术治疗时,亦应先预置肝门阻断管。切断肝周韧带,使血管瘤充分游离后,阻断第一肝门进而使血管瘤缩小,然后用手指轻压瘤体,用大号弯圆针,7号或10号丝线从靠近血管瘤的正常肝组织进针,并经过肿瘤基底部,再从肿瘤另一侧正常肝组织出针,暂不结扎,依血管瘤大小,用同样方法间断或“8”字形缝合(针距1~1.5cm),缝合整个瘤体,然后逐一收紧打结。捆扎时应注意进针不可经瘤体,以免放松肝门阻断后,从针眼处发生大出血。这种方法能很好地达到控制血管瘤生长的目的。 3.肝动脉结扎和肝动脉栓塞术 对多发性血管瘤或病变范围极大,已侵犯大部分肝组织或紧邻大血管,无法切除者,可作肝动脉结扎或栓塞术,根据病变范围可作肝右、肝左或肝固有动脉结扎术。结扎后大部分肿瘤可变软缩小,该法对囊状血管瘤的疗效甚为满意。在肿瘤缩小的基础上,术后加用放射治疗可促使肿瘤机化变硬,对改善症状、控制肿瘤生长有一定的作用。在一组收治的1120例中,有33例行肝动脉结扎或栓塞术,其中1例34岁女性患者,其肝上界达右锁骨中线第4肋间,下界达右肋缘下14cm,剑下12cm。术中见血管瘤侵犯全肝,无法手术切除,行肝固有动脉结扎术。术后1个月肿瘤明显缩小,肝下缘在右肋缘下9cm,剑下9cm。后经60Co照射60Gy,肿瘤继续缩小。随访21年,肝上界在右锁骨中线第5肋间,下界右肋缘下2cm,剑下3cm,质地变硬,患者体重增加,肝功能正常,已恢复工作。 近年来,随着介入放射学技术的发展,对已确诊为肝海绵状血管瘤且手术切除可能性较小的患者,可经股动脉行肝动脉栓塞术,亦能达到控制血管瘤发展的目的。常用的栓塞剂为碘油、微球(清蛋白微球、明胶微球及乙基纤维素微球等)、吸收性明胶海绵等,亦可用记忆合金钢圈行永久性栓塞。根据病变范围可行肝左或肝右动脉栓塞,通常无不良反应,术后大部分患者可见肿瘤缩小。 4.冷冻治疗 对既不能手术切除,又无法作动脉结扎的肝海绵状血管瘤,且经股动脉行肝动脉栓塞失败者,可在肝门阻断、肿瘤变软缩小后,再用冷冻疗法。一般用液氮,温度最低可达-196℃。冷冻方法大致有3种:①接触冷冻:将冷冻头置于组织表面加压冷冻,可产生半球形冰冻块,冷冻深度约为冷冻面积的半径;②插入冷冻:用针形冷冻头插入血管瘤内,以达到较深部位的治疗;③液氮直接喷冻:适用于表面积较大的弥漫性浅表病变。冷冻时间取决于冷冻方法、病灶大小和深浅度。通常冷冻15min可达80%~90%最大冷冻效应,故一般单次冷冻15~30min。在快速冷冻、缓慢自然溶解过程中,能使冷冻区产生凝固性坏死。术中可用2支热电偶针分别监测冷冻区及边缘肝组织的温度。在肝门阻断下冷冻1次效应相当于不阻断肝门冷冻的2~3次。术后ALT可有一过性升高,多在1~2周内恢复正常。胆囊及一、二级胆管冷冻后有破溃形成胆漏的危险,故对位于肝门部的血管瘤不宜采用此法。 5.微波固化术 对巨大血管瘤无法暴露肝门或第一、二肝门受侵犯,范围太大无法行肿瘤切除者,可采用微波固化。对因瘤体巨大妨碍肝门显露者,可先行微波固化至瘤体明显缩小后再行血管瘤切除。对于无法切除者,单纯做微波高温固化治疗亦可获得较满意的疗效。 在1120例患者中,采用微波固化治疗巨大肝血管瘤23例,最大瘤体直径26cm。全部病例肿瘤经固化治疗后,肿瘤直径可缩小70%~90%,解除了压迫症状,显著减轻了患者的痛苦。其中2例分别于术后3个月、20个月对缩小后的血管瘤作手术切除,切除标本中可见血管瘤已完全纤维化。 6.瘤体内硬化剂注射术 最常采用的是
(1)充分显露肿瘤,一般作肋缘下斜切口,如果肿瘤位于右半肝,切口可自剑突沿右肋缘下至右第12肋;如果肿瘤位于左半肝,显露困难,则可以采用双肋缘下“人”字形切口,这样可充分显露肿瘤便于操作;对于需行右三叶切除的巨大肝血管瘤,必要时可作胸腹联合切口。 (2)充分游离肝脏,在分离肿瘤和切肝前,可先结扎患侧肝动脉,使肿瘤缩小、变软,有利于手术操作。通常采用先在肝十二指肠韧带处放置一根橡皮管,以阻断入肝血流,更便于分离和切除肿瘤,且可防止手术过程中大出血。切肝前应仔细分离、切断和结扎肿瘤周围诸韧带及粘连组织,使肿瘤和患侧肝脏充分游离,游离的程度以达到术者可以用手握住肝切线并控制肝创面出血为原则。对于右肝巨大血管瘤已达肝后下腔静脉前壁者,充分游离右侧肝脏后,可以将肝脏向左侧翻转,仔细分离,暴露下腔静脉前壁的肝短静脉,逐根结扎,以免切肝时撕破下腔静脉壁或拉断肝短静脉。 (3)切肝应在常温下阻断肝门后进行,每次阻断时间为15~20min,如1次阻断未能切下,放松3~5min后,再行第2次阻断,直至把肿瘤切下为止;如果有可能,可以选择性地阻断患侧肝脏的肝门,这样可以延长阻断时间。 (4)肝切线的选择,肝切线应选在偏向或靠近正常肝组织处,用血管钳边钳夹、边切断结扎所有断面血管和胆管。直至肿瘤完全切除。多发性血管瘤或血管瘤病变广泛,需作局部或主瘤切除者,应注意切线尽量靠近正常肝组织,不然易引起大出血;切忌在瘤体上切割或缝扎,以免造成渗血不止;待主瘤切除后,小的血管瘤可用捆扎法处理。 (5)肿瘤切除后,应对肝创面进行彻底止血,活动性出血可以行“8”字缝合,无明显出血后,可用一片游离大网膜覆盖肝创面并缝合固定,也可用对拢缝合肝创面。后腹膜粗糙面予以缝合止血,膈下置双套管持续负压吸引。 (6)对巨大肝海绵状血管瘤切除时,术前还应从颈外静脉或颈内静脉或大隐静脉放置中心静脉导管至右心房附近,供输液或输血或术中测量中心静脉压用。因瘤体可压迫下腔静脉,造成静脉回流不畅,故全部输液输血应在上肢进行,并常规显露一侧桡动脉,以便在大出血时作紧急动脉输血用,以利提高手术安全性。 2.血管瘤捆扎术 对血管瘤直径在15cm以下、多发性小血管瘤或主瘤切除后其他肝叶散在的小血管瘤,均可采用血管瘤捆扎术。在采用血管瘤捆扎术治疗时,亦应先预置肝门阻断管。切断肝周韧带,使血管瘤充分游离后,阻断第一肝门进而使血管瘤缩小,然后用手指轻压瘤体,用大号弯圆针,7号或10号丝线从靠近血管瘤的正常肝组织进针,并经过肿瘤基底部,再从肿瘤另一侧正常肝组织出针,暂不结扎,依血管瘤大小,用同样方法间断或“8”字形缝合(针距1~1.5cm),缝合整个瘤体,然后逐一收紧打结。捆扎时应注意进针不可经瘤体,以免放松肝门阻断后,从针眼处发生大出血。这种方法能很好地达到控制血管瘤生长的目的。 3.肝动脉结扎和肝动脉栓塞术 对多发性血管瘤或病变范围极大,已侵犯大部分肝组织或紧邻大血管,无法切除者,可作肝动脉结扎或栓塞术,根据病变范围可作肝右、肝左或肝固有动脉结扎术。结扎后大部分肿瘤可变软缩小,该法对囊状血管瘤的疗效甚为满意。在肿瘤缩小的基础上,术后加用放射治疗可促使肿瘤机化变硬,对改善症状、控制肿瘤生长有一定的作用。在一组收治的1120例中,有33例行肝动脉结扎或栓塞术,其中1例34岁女性患者,其肝上界达右锁骨中线第4肋间,下界达右肋缘下14cm,剑下12cm。术中见血管瘤侵犯全肝,无法手术切除,行肝固有动脉结扎术。术后1个月肿瘤明显缩小,肝下缘在右肋缘下9cm,剑下9cm。后经60Co照射60Gy,肿瘤继续缩小。随访21年,肝上界在右锁骨中线第5肋间,下界右肋缘下2cm,剑下3cm,质地变硬,患者体重增加,肝功能正常,已恢复工作。 近年来,随着介入放射学技术的发展,对已确诊为肝海绵状血管瘤且手术切除可能性较小的患者,可经股动脉行肝动脉栓塞术,亦能达到控制血管瘤发展的目的。常用的栓塞剂为碘油、微球(清蛋白微球、明胶微球及乙基纤维素微球等)、吸收性明胶海绵等,亦可用记忆合金钢圈行永久性栓塞。根据病变范围可行肝左或肝右动脉栓塞,通常无不良反应,术后大部分患者可见肿瘤缩小。 4.冷冻治疗 对既不能手术切除,又无法作动脉结扎的肝海绵状血管瘤,且经股动脉行肝动脉栓塞失败者,可在肝门阻断、肿瘤变软缩小后,再用冷冻疗法。一般用液氮,温度最低可达-196℃。冷冻方法大致有3种:①接触冷冻:将冷冻头置于组织表面加压冷冻,可产生半球形冰冻块,冷冻深度约为冷冻面积的半径;②插入冷冻:用针形冷冻头插入血管瘤内,以达到较深部位的治疗;③液氮直接喷冻:适用于表面积较大的弥漫性浅表病变。冷冻时间取决于冷冻方法、病灶大小和深浅度。通常冷冻15min可达80%~90%最大冷冻效应,故一般单次冷冻15~30min。在快速冷冻、缓慢自然溶解过程中,能使冷冻区产生凝固性坏死。术中可用2支热电偶针分别监测冷冻区及边缘肝组织的温度。在肝门阻断下冷冻1次效应相当于不阻断肝门冷冻的2~3次。术后ALT可有一过性升高,多在1~2周内恢复正常。胆囊及一、二级胆管冷冻后有破溃形成胆漏的危险,故对位于肝门部的血管瘤不宜采用此法。 5.微波固化术 对巨大血管瘤无法暴露肝门或第一、二肝门受侵犯,范围太大无法行肿瘤切除者,可采用微波固化。对因瘤体巨大妨碍肝门显露者,可先行微波固化至瘤体明显缩小后再行血管瘤切除。对于无法切除者,单纯做微波高温固化治疗亦可获得较满意的疗效。 在1120例患者中,采用微波固化治疗巨大肝血管瘤23例,最大瘤体直径26cm。全部病例肿瘤经固化治疗后,肿瘤直径可缩小70%~90%,解除了压迫症状,显著减轻了患者的痛苦。其中2例分别于术后3个月、20个月对缩小后的血管瘤作手术切除,切除标本中可见血管瘤已完全纤维化。 6.瘤体内硬化剂注射术 最常采用的是 浙公网安备
33010902000463号
浙公网安备
33010902000463号



