-
科室:
暂无
-
别名:
carcinoma of cervical stump
-
症状:
暂无
-
发病部位:
暂无
-
多发人群:
女性
-
相关疾病:
暂无
宫颈残端癌是指子宫次全切除术后所残留的宫颈部分发生癌变。宫颈残端癌可在子宫次全切除术后数月至2年内发病,也可在数年或更长的时间发病。根据文献报道和多数学者的意见,术后2年内发现宫颈残端癌变时不能诊断为宫颈残端癌,而切除子宫2年后发现病变才诊断为宫颈残端癌。LoneK(1992)认为,子宫次全切除术后2年以内出现的宫颈残端癌,很可能是在手术时已患有宫颈癌而没有在术前得到确诊,属于遗漏的宫颈癌。真正的宫颈残端癌系指:子宫次全切除术时不论宫颈阴道部或颈管确无癌变存在且在术后2年新发病者,才称为真性宫颈残端癌。
子宫颈残端癌是由于其他妇科病行子宫次全切除术后,引发残留的子宫颈癌变。宫颈癌变的病因包括: 1.性行为 初次性交年龄过早、多个性伴侣及男性伴侣的性行为,都被认为和宫颈癌的发生相关。认为这与青春期宫颈处于鳞状上皮化生时期,对致癌物较为敏感有关。 50多年前人们就发现在修女中宫颈癌极罕见。继之许多研究指出婚产情况及性混乱,如初次性交过早、多个性伴侣和宫颈癌密切相关。20世纪70年代有报道宫颈癌的病死率和淋病的发病率之间有关,因而认为宫颈癌大多是由性传播疾病感染所引起的。在这些性因素中和宫颈癌关系最恒定的是性伴侣数(表1),表中列举的是病例对照研究结果。研究结果指出宫颈癌妇女较对照组妇女有更多的性伴侣,且患病的危险性直接与性伴侣数成正比。有≥10个性伴侣者较≤1个性伴侣者的相对危险性高3倍以上。事实说明多个性伴侣与CIN及宫颈癌均有明显的相关性,但与前者的相关性更明显。Slattery曾在一项研究中推算,性伴侣数≥10个者在宫颈癌新病例中占36%。当性伴侣数≥6个且初次性交年龄在15岁以前时,则患宫颈癌的危险性上升5~10倍以上。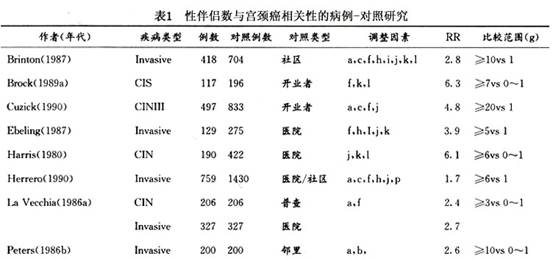
 流行病学研究还发现初次性交年龄为16岁者,其相对危险性为20岁以上的两倍(表2)。有学者指出初婚年龄在18岁以下者,比25岁以上者的患病率高13.3倍。Biswas(1997)报道初次性交年龄在12岁以下和≥18岁者相比,OR值为3.5,且与宫颈癌的关系不依赖其他因素而独立存在。
流行病学研究还发现初次性交年龄为16岁者,其相对危险性为20岁以上的两倍(表2)。有学者指出初婚年龄在18岁以下者,比25岁以上者的患病率高13.3倍。Biswas(1997)报道初次性交年龄在12岁以下和≥18岁者相比,OR值为3.5,且与宫颈癌的关系不依赖其他因素而独立存在。
 性关系的特征可能也影响宫颈癌的危险性。一些学者对不同年龄阶段的性伴侣数也进行了分析。Brinton(1987)及Herrero(1990)未发现20岁前的性伴侣数比终生性伴侣具有更多的意义,但Peter(1986)发现终生性伴侣的作用可全部归于20岁前多个性伴侣的作用,他还发现月经初潮及初次性交间隔时间短可提高危险性,较初次性交过早的单独作用还强,但后人未能证实。稳定的性伴侣(时间≥3个月),较不稳定的性伴侣对宫颈癌危险的相关性更大(Brinton,1987;Herrero,1990)。这个现象提示,可能需要更长期地、重复地接触携带性传播疾病的性伴侣,其危险性才增加。Herrero(1990)发现进行肛门性交者患宫颈癌的危险性亦增加,此种相关性是真实的还是仅仅反映了双方性行为的其他方面,还是与性卫生有关还不清楚。 2.人乳头瘤病毒感染 人乳头瘤病毒(human papilloma virus,HPV)感染是宫颈癌的主要危险因素。流行病学调查及临床资料分析显示,在目前发现的80余种HPV型别中约有30余型与性生殖道病变有关。 根据HPV致病力的大小及不同CIN和宫颈癌组织中HPV感染的分布情况,HPV分为高危型和低危型两大类。低危型多导致低度宫颈上皮内瘤变(CINⅠ)及扁平疣类病变,主要有HPV 6,11,30,39,42,43及44。高危型主要导致CINⅡ~Ⅲ及宫颈癌的发生,主要有HPV 16,18,31,33,35,45,52,56等。表3中所示与正常宫颈及CIN相比,宫颈浸润癌中HPV 16及18型的阳性率最高,CIN次之。而HPV 6,11型则多见于CIN中。HPV 16,18型在CINⅡ、Ⅲ级中较常见,而HPV 6、11型则在CINⅠ级中多见。HPV各亚型在宫颈浸润癌中的分布如表4,以16型最多见,其次为18型,45,31,33型占2%~5%。另有研究指出,宫颈腺癌中以HPV 18型最常见,而与鳞癌关系最大的是HPV 16型。
性关系的特征可能也影响宫颈癌的危险性。一些学者对不同年龄阶段的性伴侣数也进行了分析。Brinton(1987)及Herrero(1990)未发现20岁前的性伴侣数比终生性伴侣具有更多的意义,但Peter(1986)发现终生性伴侣的作用可全部归于20岁前多个性伴侣的作用,他还发现月经初潮及初次性交间隔时间短可提高危险性,较初次性交过早的单独作用还强,但后人未能证实。稳定的性伴侣(时间≥3个月),较不稳定的性伴侣对宫颈癌危险的相关性更大(Brinton,1987;Herrero,1990)。这个现象提示,可能需要更长期地、重复地接触携带性传播疾病的性伴侣,其危险性才增加。Herrero(1990)发现进行肛门性交者患宫颈癌的危险性亦增加,此种相关性是真实的还是仅仅反映了双方性行为的其他方面,还是与性卫生有关还不清楚。 2.人乳头瘤病毒感染 人乳头瘤病毒(human papilloma virus,HPV)感染是宫颈癌的主要危险因素。流行病学调查及临床资料分析显示,在目前发现的80余种HPV型别中约有30余型与性生殖道病变有关。 根据HPV致病力的大小及不同CIN和宫颈癌组织中HPV感染的分布情况,HPV分为高危型和低危型两大类。低危型多导致低度宫颈上皮内瘤变(CINⅠ)及扁平疣类病变,主要有HPV 6,11,30,39,42,43及44。高危型主要导致CINⅡ~Ⅲ及宫颈癌的发生,主要有HPV 16,18,31,33,35,45,52,56等。表3中所示与正常宫颈及CIN相比,宫颈浸润癌中HPV 16及18型的阳性率最高,CIN次之。而HPV 6,11型则多见于CIN中。HPV 16,18型在CINⅡ、Ⅲ级中较常见,而HPV 6、11型则在CINⅠ级中多见。HPV各亚型在宫颈浸润癌中的分布如表4,以16型最多见,其次为18型,45,31,33型占2%~5%。另有研究指出,宫颈腺癌中以HPV 18型最常见,而与鳞癌关系最大的是HPV 16型。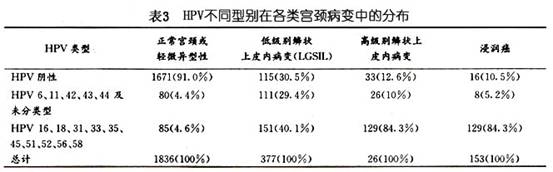
 生殖道HPV感染主要通过性传播,在性行为活跃的年轻女性中最常见,感染高峰年龄范围为18~30岁。作为一种常见的性传播疾病,HPV感染多为短暂性。大多数研究报道宫颈HPV感染的自然清除时间在7~12个月左右,只有少部分为持续感染。许多研究显示,持续性高危型HPV感染是发生宫颈病变的必要条件。有报道称,高危型HPV的持续性感染者患CINⅢ的风险增加100~300倍,而高危型HPV阴性者在随后的2年内发生HGSIL(包括CINⅡ和CINⅢ)的可能性很小,随诊中细胞学结果也由轻度或交界性异常转归为正常。 Dalstein等(2003)报道了一项对781名宫颈细胞学为正常/ASCUS/LSIL的妇女的前瞻性研究。作者对这781名妇女应用第二代杂交捕获法(HCⅡ)进行了高危型HPV (HR-IPV)检测,然后每6个月随访1次,平均随访22个月。结果显示高危型HPV阳性患者平均感染时间为7.5个月(3~42个月),大于50%的感染者在7.5个月内清除。与高危型HPV阴性者相比,HPV短暂感染和持续感染者发生宫颈细胞学ASCUS和SlL的可能性大,其相对危险度(RR)分别为2.38和9.13,所有进展到CIN2/3以上的患者都是高危型HPV持续感染者。同时作者发现,与高危型HPV阴性者相比,高危型HPV低度到中度病毒负荷者和高度病毒负荷者更易发生宫颈细胞学异常,其相对危险度(RR)分别为1.65和8.66。 Schlecht等(2001)年报道了一项前瞻性HPV持续性[收起]
子宫颈残端癌是由于其他妇科病行子宫次全切除术后,引发残留的子宫颈癌变。宫颈癌变的病因包括: 1.性行为 初次性交年龄过早、多个性伴侣及男性伴侣的性行为,都被认为和宫颈癌的发生相关。认为这与青春期宫颈处于鳞状上皮化生时期,对致癌物较为敏感有关。 50多年前人们就发现在修女中宫颈癌极罕见。继之许多研究指出婚产情况及性混乱,如初次性交过早、多个性伴侣和宫颈癌密切相关。20世纪70年代有报道宫颈癌的病死率和淋病的发病率之间有关,因而认为宫颈癌大多是由性传播疾病感染所引起的。在这些性因素中和宫颈癌关系最恒定的是性伴侣数(表1),表中列举的是病例对照研究结果。研究结果指出宫颈癌妇女较...[详细]
生殖道HPV感染主要通过性传播,在性行为活跃的年轻女性中最常见,感染高峰年龄范围为18~30岁。作为一种常见的性传播疾病,HPV感染多为短暂性。大多数研究报道宫颈HPV感染的自然清除时间在7~12个月左右,只有少部分为持续感染。许多研究显示,持续性高危型HPV感染是发生宫颈病变的必要条件。有报道称,高危型HPV的持续性感染者患CINⅢ的风险增加100~300倍,而高危型HPV阴性者在随后的2年内发生HGSIL(包括CINⅡ和CINⅢ)的可能性很小,随诊中细胞学结果也由轻度或交界性异常转归为正常。 Dalstein等(2003)报道了一项对781名宫颈细胞学为正常/ASCUS/LSIL的妇女的前瞻性研究。作者对这781名妇女应用第二代杂交捕获法(HCⅡ)进行了高危型HPV (HR-IPV)检测,然后每6个月随访1次,平均随访22个月。结果显示高危型HPV阳性患者平均感染时间为7.5个月(3~42个月),大于50%的感染者在7.5个月内清除。与高危型HPV阴性者相比,HPV短暂感染和持续感染者发生宫颈细胞学ASCUS和SlL的可能性大,其相对危险度(RR)分别为2.38和9.13,所有进展到CIN2/3以上的患者都是高危型HPV持续感染者。同时作者发现,与高危型HPV阴性者相比,高危型HPV低度到中度病毒负荷者和高度病毒负荷者更易发生宫颈细胞学异常,其相对危险度(RR)分别为1.65和8.66。 Schlecht等(2001)年报道了一项前瞻性HPV持续性[收起]
子宫颈残端癌是由于其他妇科病行子宫次全切除术后,引发残留的子宫颈癌变。宫颈癌变的病因包括: 1.性行为 初次性交年龄过早、多个性伴侣及男性伴侣的性行为,都被认为和宫颈癌的发生相关。认为这与青春期宫颈处于鳞状上皮化生时期,对致癌物较为敏感有关。 50多年前人们就发现在修女中宫颈癌极罕见。继之许多研究指出婚产情况及性混乱,如初次性交过早、多个性伴侣和宫颈癌密切相关。20世纪70年代有报道宫颈癌的病死率和淋病的发病率之间有关,因而认为宫颈癌大多是由性传播疾病感染所引起的。在这些性因素中和宫颈癌关系最恒定的是性伴侣数(表1),表中列举的是病例对照研究结果。研究结果指出宫颈癌妇女较...[详细]
宫颈残端呈不同程度糜烂,见赘生物呈菜花状、结节状、溃疡或形成空洞,宫旁组织增厚、呈结节状等。 由于子宫次全切除后残留的宫颈仍保持原有的淋巴引流,因此宫颈残端癌的扩散方式亦和一般宫颈癌一样,可向宫颈旁延伸至盆壁组织而导致腰酸、下腹不适等症状。肿瘤可沿宫颈旁淋巴结转移至盆腔和远处淋巴结。癌瘤向前方浸润,膀胱受累可有尿频、尿痛、尿血等症状,向后扩散侵犯直肠出现排便不畅、里急后重、下坠和便血等症状。
国内江森等(1992)报道的宫颈残端癌,10例临床分析发病距前次手术的时间:<5年1例,5~9年4例,10~15年3例,>15年2例。张蓉(1997)报道了12例子宫颈残端癌的治疗,分析其发病距前次手术时间为3个月~27年;其中<3年3例,3~5年2例,>10年7例。 临床症状和体征可因临床分期和肿瘤生长方式的不同而异。宫颈残端癌的早期癌病例有时可无症状,约占6%。只是普查或因其他原因检查时才被发现。宫颈残端浸润癌患者一般可有阴道不规则出血及阴道分泌物增多,主要症状和宫颈癌完全一样。有学者报道宫颈残端癌患者,75%~80%有阴道流血,10%~14%有白带增多。如果肿瘤继发感染、组织坏死,分泌物可伴有恶臭,以及腰痛、小腹下坠等症状。 1.临床分期 宫颈癌的临床分期已有70多年的历史,历经数次修改、逐步完善,开始时将肿瘤浸润到盆壁即“冰冻骨盆”列为Ⅳ期,在1937年修改分期时定为Ⅲ期;1950年修改分期时决定将宫体受侵不作为分期的标准(原分期宫体受侵定为Ⅱ期);1961年的分期标准明确0期癌为原位癌、上皮内癌,并指出0期癌病例不包括在任何治疗统计中。1970、1985年又有了隐匿癌(OCC)的概念,以及在Ⅲ期中增加了肾盂积水或肾无功能。以后又将0期和Ⅳ期的标准做了说明等。2003年在圣地亚哥(智利)召开的FI-GO会议上,又对Ⅰ期的分期标准进行了修订。此次修订后的宫颈癌临床分期标准即为目前国际统一使用的分期标准,内容见图1:
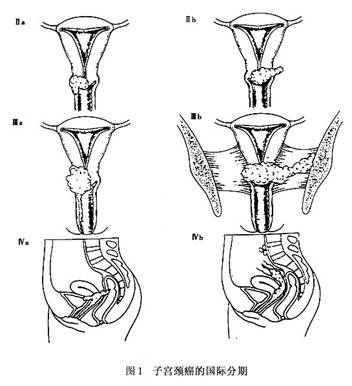 0期:原位癌、上皮内癌(此期病例不列入任何治疗统计中)。 Ⅰ期:病变局限于宫颈(宫体是否受累不予考虑)。 Ⅰa期:仅在显微镜下鉴别的浸润癌。肉眼所能见到的病变,即使浅表浸润,也属Ⅰb期;间质浸润的深度<5mm,宽度<7mm(浸润深度从肿瘤部位上皮或腺体基底膜向下<5mm),静脉或淋巴管区的浸润不改变分期。 Ⅰa1期:间质浸润深度<3mm,宽度<7mm。 Ⅰa2期:间质浸润深度为3~5mm,宽度<7mm。 Ⅰb期:临床检查病变局限于宫颈或临床前病变大于Ⅰa期。 Ⅰb1期:临床可见病变直径<4cm。 Ⅰb2期:临床可见病变直径>4cm。 Ⅱ期:病变超出宫颈,但未至盆壁,阴道浸润未到阴道下1/3。 Ⅱa期:无明显宫旁浸润。 Ⅱb期:有明显宫旁浸润。 Ⅲ期:病变浸润达盆壁,直肠检查时肿瘤与盆壁间无间隙;癌累及阴道下1/3;无其他原因的肾盂积水或肾无功能。 Ⅲa期:病变未达盆壁,但累及阴道下1/3。 Ⅲb期:病变已达盆壁或有肾盂积水或肾无功能。 Ⅳ期:病变已超出真骨盆或临床已浸润膀胱或直肠黏膜。 Ⅳa期:病变扩散至邻近器官。 Ⅳb期:病变转移至远处器官。 2.分期注意事项 (1)0期包括上皮全层均有不典型细胞,但无间质浸润者。 (2)Ⅰa(Ⅰa1及Ⅰa2)期诊断必须根据显微镜下的观察确定。 (3)Ⅲ期的诊断应为宫旁浸润达盆壁、肿瘤与盆壁间无间隙,而且增厚为结节状时,方能确定。 (4)即使根据其他检查定为Ⅰ或Ⅱ期,但有癌性输尿管狭窄而产生肾盂积水或肾无功能时,亦应列为Ⅲ期。 (5)膀胱泡样水肿不能列为Ⅳ期。膀胱镜检查见到隆起及沟裂,并在同时通过阴道或直肠能确诊证实该隆起或沟裂与肿瘤固定时,应视为膀胱黏膜下受侵,膀胱冲洗液有恶性细胞时,应在膀胱壁取活体组织病理检查证实。[收起]
国内江森等(1992)报道的宫颈残端癌,10例临床分析发病距前次手术的时间:<5年1例,5~9年4例,10~15年3例,>15年2例。张蓉(1997)报道了12例子宫颈残端癌的治疗,分析其发病距前次手术时间为3个月~27年;其中<3年3例,3~5年2例,>10年7例。 临床症状和体征可因临床分期和肿瘤生长方式的不同而异。宫颈残端癌的早期癌病例有时可无症状,约占6%。只是普查或因其他原因检查时才被发现。宫颈残端浸润癌患者一般可有阴道不规则出血及阴道分泌物增多,主要症状和宫颈癌完全一样。有学者报道宫颈残端癌患者,75%~80%有阴道流血,10%~14%有白带增多。如果肿瘤继发感染、组织...[详细]
0期:原位癌、上皮内癌(此期病例不列入任何治疗统计中)。 Ⅰ期:病变局限于宫颈(宫体是否受累不予考虑)。 Ⅰa期:仅在显微镜下鉴别的浸润癌。肉眼所能见到的病变,即使浅表浸润,也属Ⅰb期;间质浸润的深度<5mm,宽度<7mm(浸润深度从肿瘤部位上皮或腺体基底膜向下<5mm),静脉或淋巴管区的浸润不改变分期。 Ⅰa1期:间质浸润深度<3mm,宽度<7mm。 Ⅰa2期:间质浸润深度为3~5mm,宽度<7mm。 Ⅰb期:临床检查病变局限于宫颈或临床前病变大于Ⅰa期。 Ⅰb1期:临床可见病变直径<4cm。 Ⅰb2期:临床可见病变直径>4cm。 Ⅱ期:病变超出宫颈,但未至盆壁,阴道浸润未到阴道下1/3。 Ⅱa期:无明显宫旁浸润。 Ⅱb期:有明显宫旁浸润。 Ⅲ期:病变浸润达盆壁,直肠检查时肿瘤与盆壁间无间隙;癌累及阴道下1/3;无其他原因的肾盂积水或肾无功能。 Ⅲa期:病变未达盆壁,但累及阴道下1/3。 Ⅲb期:病变已达盆壁或有肾盂积水或肾无功能。 Ⅳ期:病变已超出真骨盆或临床已浸润膀胱或直肠黏膜。 Ⅳa期:病变扩散至邻近器官。 Ⅳb期:病变转移至远处器官。 2.分期注意事项 (1)0期包括上皮全层均有不典型细胞,但无间质浸润者。 (2)Ⅰa(Ⅰa1及Ⅰa2)期诊断必须根据显微镜下的观察确定。 (3)Ⅲ期的诊断应为宫旁浸润达盆壁、肿瘤与盆壁间无间隙,而且增厚为结节状时,方能确定。 (4)即使根据其他检查定为Ⅰ或Ⅱ期,但有癌性输尿管狭窄而产生肾盂积水或肾无功能时,亦应列为Ⅲ期。 (5)膀胱泡样水肿不能列为Ⅳ期。膀胱镜检查见到隆起及沟裂,并在同时通过阴道或直肠能确诊证实该隆起或沟裂与肿瘤固定时,应视为膀胱黏膜下受侵,膀胱冲洗液有恶性细胞时,应在膀胱壁取活体组织病理检查证实。[收起]
国内江森等(1992)报道的宫颈残端癌,10例临床分析发病距前次手术的时间:<5年1例,5~9年4例,10~15年3例,>15年2例。张蓉(1997)报道了12例子宫颈残端癌的治疗,分析其发病距前次手术时间为3个月~27年;其中<3年3例,3~5年2例,>10年7例。 临床症状和体征可因临床分期和肿瘤生长方式的不同而异。宫颈残端癌的早期癌病例有时可无症状,约占6%。只是普查或因其他原因检查时才被发现。宫颈残端浸润癌患者一般可有阴道不规则出血及阴道分泌物增多,主要症状和宫颈癌完全一样。有学者报道宫颈残端癌患者,75%~80%有阴道流血,10%~14%有白带增多。如果肿瘤继发感染、组织...[详细]
1.宫颈刮片细胞学检查 普遍用于宫颈癌筛查。必须在宫颈移行区刮片检查,主要依据细胞核变化判断细胞恶性。 2.碘试验 碘试验对癌无特异性,利用正常宫颈上皮富含糖原,会被碘染成棕黑色,而癌上皮缺乏糖原,碘染不着色。在不着色区域取活组织,提高诊断准确率。
1.阴道镜检查 观察宫颈表面有无异型上皮或早期癌变,并选择病变部位进行活组织检查,以提高诊断准确率。 2.宫颈和宫颈管活组织检查 是确诊宫颈癌及其癌前病变最可靠和不可缺少的方法。
根据症状和体征、临床检查及病理诊断宫颈残端癌并不困难,诊断和一般宫颈癌的诊断相同。有的学者认为宫颈残端癌诊断时的期别要比一般宫颈癌诊断时的期别要晚,但也有学者认为,由于子宫次全切除术后出现阴道出血比没有手术者更能引起患者的注意,因此早期病例占多数。宫颈残端癌由于切除了子宫体及前次手术造成的解剖学改变,以及可能出现的并发症,使治疗较为困难,因此早期诊断尤为重要。
宫颈残端癌的治疗方法与一般宫颈癌相同,以手术、放疗为主,晚期病例则采取手术、放疗及化疗的综合治疗,治疗效果与放化疗前临床分期、组织病理形态、肿瘤生长方式及患者的全身状况有关。 由于子宫体已切除,膀胱、直肠和宫颈残端粘连,加之周围形成的粘连灶和瘢痕,都给治疗带来了困难。 手术治疗适用于早期宫颈残端癌。术中要特别注意解剖关系,防止及减少并发症(江森,1992)。如果手术切除不满意,可以术后给予放射治疗以提高疗效,但可能出现一些并发症。Petersen(1992)报道3例早期病例(Ⅰa、Ⅰb、Ⅱa)接受宫颈切除术,但未行淋巴结清扫,其中2例术后行体外照射和腔内治疗,均无复发。 多数Ⅱ、Ⅲ期宫颈残端癌患者和普通宫颈癌一样采用放射治疗,腔内治疗仍然是残端癌放射治疗的重要组成部分。但由于宫体已切除,颈管缩短,导致腔内照射的总剂量减少,增加了局部复发的可能性。如果提高腔内治疗的剂量,则可使生存率达到普通宫颈癌的水平,但放射性直肠炎和膀胱炎的发病率相应增高。Petersen(1992)在分析43例宫颈残端癌的放疗时指出:残端癌的发生率低,治疗较普通宫颈癌困难,手术难度大,绝大多数病人选择放疗,但放疗的并发症较一般宫颈癌高。因此,有必要考虑用不同的放疗方法降低并发症的发生率。孙建衡(1992)在总结子宫颈癌后装治疗5年的经验时指出,适当减少腔内放射次数,采取部分全盆照射,可降低放疗的并发症。张蓉(1997)分析12例宫颈残端癌的治疗,其中9例患者接受了体外全盆照射,肿瘤剂量2000~4000cGy,腔内后装治疗3~5次,A点剂量6~23Gy,其中1例死于其他原因,2例死于肿瘤,存活率与普通宫颈癌相同,且无严重的并发症发生。 中国医学科学院肿瘤医院放射治疗宫颈残端癌,注重体外照射的作用。全盆照射剂量可在3000~5000cGy之间选择,同时腔内后装治疗,可采用组织内插植和阴道容器消除宫颈的大体积肿瘤。如果宫颈管残留长度为2.5~3cm,则可增加腔内治疗剂量,有利于局部肿瘤的控制,但要减少体外全盆照射剂量。体外照射剂量可根据腔内治疗的情况增加或减少,但总的A点剂量可在6000~7000cGy之间调整。[收起]
宫颈残端癌的治疗方法与一般宫颈癌相同,以手术、放疗为主,晚期病例则采取手术、放疗及化疗的综合治疗,治疗效果与放化疗前临床分期、组织病理形态、肿瘤生长方式及患者的全身状况有关。 由于子宫体已切除,膀胱、直肠和宫颈残端粘连,加之周围形成的粘连灶和瘢痕,都给治疗带来了困难。 手术治疗适用于早期宫颈残端癌。术中要特别注意解剖关系,防止及减少并发症(江森,1992)。如果手术切除不满意,可以术后给予放射治疗以提高疗效,但可能出现一些并发症。Petersen(1992)报道3例早期病例(Ⅰa、Ⅰb、Ⅱa)接受宫颈切除术,但未行淋巴结清扫,其中2例术后行体外照射和腔内治疗,均无复发。...[详细]
依据病变扩散的范围和临床分期,宫颈残端癌的预后与普通宫颈癌基本相同。Petersen(1992)报道28例宫颈残端癌体外加腔内放疗,5年存活率为62%;张蓉(1997)报道体外照射加腔内后装治疗9例,存活6例,存活率66.7%,因此腔内后装治疗与体外照射相结合可以获得较好的治疗效果。然而Wolff等认为隐性癌的预后较差,因为病情进展快,转移率高。Peterson(1992)报道28例5年存活率为62%,总之,临床分期和治疗方案对预后的影响颇大。
为了减少宫颈残端癌的发生,在决定行子宫次全切除或全子宫切除术之前必须严格检查排除宫颈癌。在行次全子宫切除术后,患者应定期参加普查,而早期诊断、及时适当的治疗对残端癌更为重要。次全子宫切除术后应定期检查,如常规做宫颈防癌涂片检查,必要时做固有荧光光谱诊断、阴道镜检查及宫颈活组织检查等排除恶变,以免漏诊。次全子宫切除后若患者主诉阴道流血应及早诊治。患者治疗后,还应定期按常规随访,如有复发应积极进行治疗。